Hola.
Para quienes no tienen la teoría de lo que estuvimos repasando en clase, les dejo los enlaces de este mismo blog para estar al día:
isótopos;
masa atómica relativa.
En esta oportunidad intentaremos aclarar un poco este concepto que a simple vista confunde.
Científicamente, diremos que es la representación del modelo atómico de Schrödinger o modelo de la
mecánica cuántica. En esta representación se indican los
niveles,
subniveles y los
orbitales que ocupan los electrones.
Para empezar recordemos que los átomos (organizados en la
tabla periódica) pueden tener hasta siete (7)
niveles de energía llamados NÚMERO CUÁNTICO PRINCIPAL (
n) o también órbitas, cada una indicada como período en la tabla (filas).
Cada
n, posee subniveles llamados NÚMERO CUÁNTICO SECUNDARIO (
l) relacionado con
n simplemente restandole uno. Es decir, si
n = 1 =>
l = 0; si
n = 4 =>
l = 3.
Para evitar confusiones con tantos números, los científicos decidieron reemplazar los primeros números cuánticos secundarios con letras de la siguiente manera:
l = 0 => l = s (sharp)
l = 1 => l = p (principal)
l = 2 => l = d (difuso)
l = 3 => l = f (fundamental)
Luego a cada
orbital lo denominaremos juntando los datos
n y
l. Por ejemplo 1s, 2s, sp, etc.
Con respecto a la forma del
orbital de estos subniveles (
s, p, d, f) determinan la
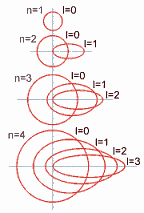
excentricidad de la órbita: cuanto mayor sea este número relacionado a las letras, más excéntrica será la órbita; es decir, será más aplanada la elipse que recorre el electrón.
Así, en el nivel 1 el valor del subnivel es cero (no hay excentricidad) y su
órbita es circular.
Cada vez que aumenta el valor del número cuántico secundario (o azimutal) aumenta la excentricidad de la órbita, como se demuestra en el siguiente gráfico:
Repasemos:
| Niveles de energía (n) |
1
|
2
|
3
|
4
|
| Tipo de subniveles |
s
|
s p
|
s p d
|
s p d f
|
| Número de orbitales en cada subnivel |
1
|
1 3
|
1 3 5
|
1 3 5 7
|
| Denominación de los orbitales |
1s
|
2s 2p
|
3s 3p 3d
|
4s 4p 4d 4f
|
| Número máximo de electrones en los orbitales |
2
|
2 - 6
|
2 - 6 - 10
|
2 - 6 - 10 - 14
|
| Número máximo de electrones por nivel de energía |
2
|
8
|
18
|
32
|
A medida que se acrecenta la cantidad de electrones orbitando el núcleo del átomo se van agregando orbitales con el siguiente orden.
Los orbitales se pueden representar también en espacios donde se ubican hasta dos electrones con diferente spin (significa giro o girar) los cuales se llenan como se va a continuación:
Algunos ejemplos:
Hasta completar el orbital, los e- se ubican desapareados. Como puede verse, el sexto e- del C se colocó en el segundo espacio destinado a los e- del orbital 2p.
Siguiendo todo lo explicado, complete como en el último esquema, la configuración electrónica del Cl y del Ca.