Estimados alumnos, durante esta semana se están definiendo las notas en esta materia.
Por esto les pido que tengan la carpeta completa que será corregida.
Continúen el camino del aprendizaje aun fuera de la escuela porque el conocimiento es poder.
Nunca pierdan la humildad.
Saludos.
La humildad nos ayuda a reconocer esta sentencia obvia: nadie lo sabe todo, nadie lo ignora todo. Todos sabemos algo, todos ignoramos algo. Paulo Freire en "Cartas a quien pretende enseñar".
martes, 3 de diciembre de 2013
sábado, 9 de noviembre de 2013
Clasificación de glúcidos
Según su complejidad, se los clasifica en:
a) Monosas o monosacáridos. Son glúcidos que no se hidrolizan, es decir, que no pueden descomponerse en otros glúcidos mas sencillos. Comprenden sustancias que tienen entre tres y ocho átomos de carbono. Según el valor de este número, se los llama: triosas, tetrosas, pentosas, hexosas, heptosas y octosas. Las más importantes son las pentosas y las hexosas.
Ejemplos:
b) Oligosacáridos. Son hidratos de carbono que al hidrolizarse dan unas pocas monosas, pero en definido número de moléculas. Comprenden:
Fuente: QUÍMICA ORGÁNICA. De Biasioli y otros. Kapelusz. 1980.
a) Monosas o monosacáridos. Son glúcidos que no se hidrolizan, es decir, que no pueden descomponerse en otros glúcidos mas sencillos. Comprenden sustancias que tienen entre tres y ocho átomos de carbono. Según el valor de este número, se los llama: triosas, tetrosas, pentosas, hexosas, heptosas y octosas. Las más importantes son las pentosas y las hexosas.
Ejemplos:
C3H6O3 C5H10O5
triosa pentosa
b) Oligosacáridos. Son hidratos de carbono que al hidrolizarse dan unas pocas monosas, pero en definido número de moléculas. Comprenden:
- disacáridos, que se hidrolizan dando dos monosas: la fórmula molecular es C12H22O11 , se los puede considerar formados por la unión de dos hexosas (C6H12O6 ) que pierden una molécula de agua:
2 C6H12O6 ----------------> C12H22O11 + H2O
- trisacáridos, que dan tres monosas: algo similar a los disacáridos pero con la exclusión de dos moléculas de agua:
3 C6H12O6 ----------------> C18H32O16 + 2 H2O
- tetrasacáridos, pentasacáridos, hexasacáridos (que dan cuatro, cinco o seis monosas).
Fuente: QUÍMICA ORGÁNICA. De Biasioli y otros. Kapelusz. 1980.
miércoles, 30 de octubre de 2013
Glúcidos -o Hidratos de carbono-
Comencemos con este video como introducción bien didáctico (poco más de 10 minutos).
Ahora iremos por partes:
Los glúcidos, carbohidratos o hidratos de carbono están distribuidos ampliamente en los reinos animal y vegetal, formando parte de los constituyentes de las células y como sustancia de reserva (almidón de trigo, maíz, féculas de los tubérculos) o de sostén (celulosa). La glucosa se encuentra en la uva; la sacarosa, especialmente en la caña de azúcar y en la remolacha. En los organismos animales, los glúcidos se encuentran en la sangre (glucosa) y en todas las células. Hay depósitos de glucógeno (sustancia de reserva) en los músculos y en el hígado. Son sustancias primordiales en la dieta alimenticia, ya que su oxidación en el interior de los tejidos produce la energía necesaria para la para las funciones del organismo. También revisten gran importancia desde el punto de vista industrial, ya que son la materia prima para la elaboración de muchos productos, como la celulosa, empleada en la fabricación de papel, celuloide, fibras sintética y explosivos.
Cuantitativamente, forman la mayor parte de la materia orgánica de la Tierra. El nombre "hidratos de carbono" les fue dado cuando se observó que al calentarlos se descomponen, desprendiendo agua y dejando un residuo carbonoso. Se les asignó la fórmula Cx(H2O)y, donde x e y pueden ser iguales o diferentes.
Son sustancias ternarias, formadas por carbono, hidrógeno y oxígeno, en las que los dos últimos elementos están en la relación 2:1, como por ejemplo en la glucosa: C6H12O6. Hay algunas sustancias que por sus propiedades deben situarse entre los glúcidos, y sin embargo no se ajustan a la fórmula mencionada; por el contrario, otras como el ácido acético ó el ácido láctico, a pesar de su fórmula molecular, no son glúcidos.
Se los llama también "azúcares" o "sacáridos", porque muchos de ellos tienen sabor dulce, semejante al de la sacarosa o azúcar común.
Desde el punto de vista de su composición química, son polihidroxialdehídos o polihidroxicetonas, o bien sustancias que pueden producirlos por hidrólisis:
Ahora iremos por partes:
Los glúcidos, carbohidratos o hidratos de carbono están distribuidos ampliamente en los reinos animal y vegetal, formando parte de los constituyentes de las células y como sustancia de reserva (almidón de trigo, maíz, féculas de los tubérculos) o de sostén (celulosa). La glucosa se encuentra en la uva; la sacarosa, especialmente en la caña de azúcar y en la remolacha. En los organismos animales, los glúcidos se encuentran en la sangre (glucosa) y en todas las células. Hay depósitos de glucógeno (sustancia de reserva) en los músculos y en el hígado. Son sustancias primordiales en la dieta alimenticia, ya que su oxidación en el interior de los tejidos produce la energía necesaria para la para las funciones del organismo. También revisten gran importancia desde el punto de vista industrial, ya que son la materia prima para la elaboración de muchos productos, como la celulosa, empleada en la fabricación de papel, celuloide, fibras sintética y explosivos.
Cuantitativamente, forman la mayor parte de la materia orgánica de la Tierra. El nombre "hidratos de carbono" les fue dado cuando se observó que al calentarlos se descomponen, desprendiendo agua y dejando un residuo carbonoso. Se les asignó la fórmula Cx(H2O)y, donde x e y pueden ser iguales o diferentes.
Son sustancias ternarias, formadas por carbono, hidrógeno y oxígeno, en las que los dos últimos elementos están en la relación 2:1, como por ejemplo en la glucosa: C6H12O6. Hay algunas sustancias que por sus propiedades deben situarse entre los glúcidos, y sin embargo no se ajustan a la fórmula mencionada; por el contrario, otras como el ácido acético ó el ácido láctico, a pesar de su fórmula molecular, no son glúcidos.
Desde el punto de vista de su composición química, son polihidroxialdehídos o polihidroxicetonas, o bien sustancias que pueden producirlos por hidrólisis:
Tarea:
Esquematizar una molécula de butanotriol-al y una de butanotriol-ona, conociendo de clases anteriores el significado de los sufijos al y ona.
Fuente: QUÍMICA ORGÁNICA. De Biasioli y otros. Kapelusz. 1980.
viernes, 4 de octubre de 2013
Nuevo trabajo práctico
Estimados alumnos, como hablamos en clase, quedan publicadas las consignas para el nuevo trabajo.
1. Realizar un video clip (grupos de no más de tres personas)
2. El mismo debe contener el desarrollo de al menos un tema de los vistos hasta el momento.
3. Se pueden llevar a clase en pendrive, tarjeta de memoria o enviar a profesor.rubencejas@live.com.ar
4. Fecha de entrega: 9 de octubre del corriente año.
Se espera que los trabajos sean originales, que pongan en movimiento las ideas. Siempre que se lo propongan, lograrán cosas que ni siquiera ustedes esperaban. Recuerden que debe ser un trabajo serio, por lo que se espera que haya una edición (preferiblemente en VLC) que permita visualizar los nombres de los integrantes. Pueden también musicalizarlo.
No olviden mencionar de dónde sacan la información (bibliografía).
Espero buenas producciones, suerte y exitos...
1. Realizar un video clip (grupos de no más de tres personas)
2. El mismo debe contener el desarrollo de al menos un tema de los vistos hasta el momento.
3. Se pueden llevar a clase en pendrive, tarjeta de memoria o enviar a profesor.rubencejas@live.com.ar
4. Fecha de entrega: 9 de octubre del corriente año.
Se espera que los trabajos sean originales, que pongan en movimiento las ideas. Siempre que se lo propongan, lograrán cosas que ni siquiera ustedes esperaban. Recuerden que debe ser un trabajo serio, por lo que se espera que haya una edición (preferiblemente en VLC) que permita visualizar los nombres de los integrantes. Pueden también musicalizarlo.
No olviden mencionar de dónde sacan la información (bibliografía).
Espero buenas producciones, suerte y exitos...
Ácidos orgánicos
Su característica es presentar en un mismo átomo de carbono un carbonilo y un hidroxilo:



Este grupo se llama carboxilo y los ácidos orgánicos, por esa razón, son llamados ácidos carboxílicos, para distinguirlos de los ácidos minerales (clorhídrico, nítrico, etc.).
Nomenclatura
En el sistema IUPAC, un ácido se nombra cambiando la terminación del hidrocarburo correspondiente por oico.
El más sencillo de los ácidos carboxílicos tienen un solo carbono:

Como están ocupadas tres valencias del carbono, este grupo existe solamente en carbonos primarios.
La valencia libre puede ocuparla un hidrógeno, un grupo alquilo o un grupo arilo.


Nomenclatura
En el sistema IUPAC, un ácido se nombra cambiando la terminación del hidrocarburo correspondiente por oico.
El más sencillo de los ácidos carboxílicos tienen un solo carbono:
ácido propanoico (propiónico)
Si en la molécula hubieran sustituyentes o enlaces múltiples, se deb enumerar la cadena principal a partir del grupo carboxilo:
2 cloro 3 metilbutanoico

ácido 3 pentenoico
domingo, 8 de septiembre de 2013
Trabajos prácticos
Les dejo imágenes de algunos trabajos realizados por los alumnos de 5° 2a.
Se trata de moléculas de alcoholes.
Se trata de moléculas de alcoholes.
viernes, 23 de agosto de 2013
Aviso sobre el recuperatorio
Estimados alumnos, el día miércoles 4 de septiembre será el recuperatorio del exámen del pasado miércoles.
El miércoles 30 del corriente llevaré las notas del examen.
Quienes aprobaron el exámen deben rendir aldehídos y cetonas.
Quienes no aprobaron rendirán los tres temas (alcoholes, aldehídos y cetonas).
Recomiendo que estudien con tiempo. Aprovechemos esta herramienta (el blog en internet) que respeta los tiempos de cada uno.
Saludos.
El miércoles 30 del corriente llevaré las notas del examen.
Quienes aprobaron el exámen deben rendir aldehídos y cetonas.
Quienes no aprobaron rendirán los tres temas (alcoholes, aldehídos y cetonas).
Recomiendo que estudien con tiempo. Aprovechemos esta herramienta (el blog en internet) que respeta los tiempos de cada uno.
Saludos.
Aldehídos y Cetonas (cetonas)
Como se vió en el artículo anterior, las cetonas tienen el grupo carbonilo unido a un carbono secundario:
Nomenclatura de las cetonas. Su nombre se obtiene cambiando la terminación o del hidrocarburo correspondiente por ona. La posición del grupo carbonilo se indicará por medio de números, si fuera necesatio precisar el compuesto.
Ejemplos:
R - C - R
||
O
Por esta razón, la cetona más sencilla tiene tres átomos de carbono:
CH3 - C - CH3
||
O
Nomenclatura de las cetonas. Su nombre se obtiene cambiando la terminación o del hidrocarburo correspondiente por ona. La posición del grupo carbonilo se indicará por medio de números, si fuera necesatio precisar el compuesto.
Ejemplos:
CH3 - C - CH3 CH3 - CH2 - CH2 - C - CH3
|| ||
O O
propanona o acetona 2 pentanona
CH3 - C - C - CH3
|| ||
O O
butadiona o butanodiona
Orígen de la función cetona. Las cetonas se producen durante la oxidación de un alcohol secundario:
2 propanol + O propanona + agua
Cetonas alicíclicas. Ejemplos:
ciclobutanona ciclohexanona
Existen también aldehídos y cetonas aromáticas.
Ejercicios
- Los aldehídos y cetonas de igual número de átomos de carbono son isómeros. Escribir las fórmulas estructurales de todos los aldehídos y cetonas de cinco átomos de carbono. Nombrarlos por el sistema IUPAC
- Dar las fórmulas correspondientes a los siguientes compuestos:
a) tricloroetanal
b) 3 etilpentanodiona
c) 6 cloro 3 hexen 1 al
d) hexanopentolona
Aldehídos y Cetonas (aldehídos)
Son sustancias que tienen un átomo de oxígeno unido a uno de carbono por un enlace doble.
En los aldehídos, el oxígeno está ubicado en un carbono primario, y en las cetonas en uno secundario:
En los aldehídos, el oxígeno está ubicado en un carbono primario, y en las cetonas en uno secundario:
R R
| |
H - C = O C = O
|
R
un aldehído una cetona
El grupo [C = O] se llama grupo carbonilo y está presente en ambas funciones. En los aldehídos el carbono, por ser primario, tiene además un hidrógeno; en las cetonas no es posible que ello ocurra por ser el carbono secundario (entiéndase la R como un radical con al menos un C).
Aldehídos
En el sistema IUPAC, los aldehídos se nombran cambiando la terminación o del hidrocarburo correspondiente por al:
H H H
| | |
H - C = O CH3 - C = O CH3 - CH2 - C = O
metanal etanal propanal
Estos son aldehídos de cadena abierta o alifáticos, pero también hay aldehídos aromáticos:
benzanal o benzaldehído feniletanal
(en el esquema, cada vértice es un C)
Orígen de la función aldehído. Los aldehídos se producen por oxidación moderada de un alcohol primario con una sustancia oxidante:
etanol + O etanal + agua
Donde el átomo de O es libre, desprendido de una sustancia oxidante. Este oxígeno ha roto las uniones C - H y O - H; los dos átomos de hidrógeno eliminados han formado con el átomo de oxígeno una molécula de agua. Al queda valencias libres, se constituye una nueva unión - C = O.
Puesto que los aldehídos se originan a partir de los alcoholes primarios, su grupo funcional estará ubicado únicamente en un carbono primario.
lunes, 12 de agosto de 2013
Propiedades químicas de los alcoholes
Las reacciones de esta función pueden deberse a:
El hidrógeno del grupo hidroxilo de un alcohol primario puede ser reemplazado por metales alcalinos (Na o K), formando un alcóxido y desprendiendo hidrógeno; el alcohol se comporta como un ácido:
- ruptura del enlace O - H
- ruptura del enlace C - OH
El hidrógeno del grupo hidroxilo de un alcohol primario puede ser reemplazado por metales alcalinos (Na o K), formando un alcóxido y desprendiendo hidrógeno; el alcohol se comporta como un ácido:
2 CH3OH + 2 Na -----------> 2 CH3ONa + H2
metanol metóxido de sodio
Los alcoholes primarios presentan más reactividad frente a los metales alcalinos que los secundarios. A su vez, éstos son más reactivos que los terciarios. Esto se debe al efecto inductivo positivo de los radicales alquilo, que aumentan la densidad electrónica del oxígeno, favoreciendo la atracción del hidrógeno.
Ejercicio:
Indicar cuál de los siguientes alcoholes reaccionará más rápidamente con el sodio:
a) CH3 - CH2 - CH2OH
OH
|
b) CH3 - C - CH3
|
H
Escribir las ecuaciones correspondientes.
Ruptura del enlace C - OH
Los alcoholes en presencia de hidrácidos forman halogenuros del alquilo:
CH - [CH3 - C - CH3] OH + HCl ---------------> H2O + CH - [CH3 - C - CH3] Cl (3)
obteniendo (1) bromuro de etilo, (2) cloruro de n-propilo y (3) cloruro de ter-butilo
Escribir las ecuaciones correspondientes.
Ruptura del enlace C - OH
Los alcoholes en presencia de hidrácidos forman halogenuros del alquilo:
CH3 - CH2OH + HBr --------------> H2O + CH3 - CH2Br (1)
CH3 - CH2 - CH2OH + HCl ---------------> H2O + CH3 - CH2 - CH2Cl (2)
CH - [CH3 - C - CH3] OH + HCl ---------------> H2O + CH - [CH3 - C - CH3] Cl (3)
obteniendo (1) bromuro de etilo, (2) cloruro de n-propilo y (3) cloruro de ter-butilo
Recordando la nomenclatura IUPAC
Les dejo algunos enlaces para recordar lo que se vió en clase.
http://www.quimicaorganica.org/alcanos/nomenclatura-alcanos/209-nomenclatura-de-alcanos-reglas-iupac.html
http://docentes.umss.edu.bo/Bioquimica/jquiroga/temas/nomenclatura/iupac-nomenclatura-organica.pdf
http://www.ewp.rpi.edu/hartford/~ernesto/Juanka/Repaso-Mate-Quimica/Quimica/Documentos/NomenclaturaQuimicaOrganica.pdf
El primero es básico y los otros son archivos pdf en los cuales éncontrarán información más amplia.
Salud!
http://www.quimicaorganica.org/alcanos/nomenclatura-alcanos/209-nomenclatura-de-alcanos-reglas-iupac.html
http://docentes.umss.edu.bo/Bioquimica/jquiroga/temas/nomenclatura/iupac-nomenclatura-organica.pdf
http://www.ewp.rpi.edu/hartford/~ernesto/Juanka/Repaso-Mate-Quimica/Quimica/Documentos/NomenclaturaQuimicaOrganica.pdf
El primero es básico y los otros son archivos pdf en los cuales éncontrarán información más amplia.
Salud!
viernes, 2 de agosto de 2013
Solubilidad de los alcoholes
Los primeros términos de los alcoholes se asemejan en su estructura a la molécula de agua. Las dos moléculas nombradas son polares.
Entre ambas se pueden formar puentes de hidrógeno, lo que reduce las fuerzas de atracción entre las moléculas de cada sustancia entre sí, y los líquidos pueden disolverse.
R H R
. . . . . .
H - O : ... H - O : ... H - O : (R es un radical)
Esta característica es más acentuada en los primeros términos de los alcoholes, por lo que los dos primeros de la serie se disuelven en agua en todas las proporciones. A medida que aumenta la cadena hidrocarbonada, también aumentan las fuerzas de atracción entre ellas (fuerzas de Van der Waals), que llegan a predominar sobre la atracción del grupo oxhidrilo por las moléculas de agua. Los alcoholes muestran entonces menor solubilidad en agua y llegan a ser totalmente insolubles en el caso de los términos superiores.
Es tarea de ustedes completar el cuadro con las fórmulas.
Entre ambas se pueden formar puentes de hidrógeno, lo que reduce las fuerzas de atracción entre las moléculas de cada sustancia entre sí, y los líquidos pueden disolverse.
R H R
. . . . . .
H - O : ... H - O : ... H - O : (R es un radical)
Esta característica es más acentuada en los primeros términos de los alcoholes, por lo que los dos primeros de la serie se disuelven en agua en todas las proporciones. A medida que aumenta la cadena hidrocarbonada, también aumentan las fuerzas de atracción entre ellas (fuerzas de Van der Waals), que llegan a predominar sobre la atracción del grupo oxhidrilo por las moléculas de agua. Los alcoholes muestran entonces menor solubilidad en agua y llegan a ser totalmente insolubles en el caso de los términos superiores.
SOLUBILIDAD DE LOS ALCOHOLES
| Nombre | Fómula | Solubilidad (g/100 g H2O) |
| Metanol | completamente miscible | |
| Etanol | CH3CH2OH | completamente miscible |
| 2-Propanol | completamente miscible | |
1-Propanol
| completamente miscible | |
1-Butanol
| 9 g | |
2-Metil-1-Propanol
| 10 g | |
2-Butanol
| 12,5 g | |
2-Metil-2-Propanol
| (CH3)3COH | completamente miscible |
1-Pentanol
| 2,7 g | |
2-Pentanol
| 5,3 g | |
1-Hexanol
| 0,6 g |
lunes, 8 de julio de 2013
Propiedades físicas de los alcoholes
Los primeros términos de la serie homóloga son líquidos y los alcoholes superiores son sólidos. Son menos densos que el agua y la densidad aumenta con el número de átomos de carbono.
El agua, los alcoholes y otras sustancias presentan un punto de ebullición anormalmente alto con relación a sus peso molecular.
Si se comparan los puntos de ebullición de los alcoholes con los de los alcanos de igual número de átomos de carbono, también se observa una notable diferencia
| Punto de ebullición (°C) | Peso molecular | |
| metano CH4 | -161,5 | 16 |
| metanol CH3OH | 65,0 | 32 |
| etano CH3-CH3 | -88,6 | 30 |
| etanol CH3-CH2OH | 78,0 | 46 |
El aumento del peso molecular del alcohol con respecto al alcano no es tan grande como para justificar estas diferencias, que se pueden explicar por la unión puente de hidrógeno entre las moléculas de alcohol, similar a la que ocurre entre las moléculas de agua. Parte de la energía calorífica que se les entrega se emplea en la rotura de los puentes de hidrógeno.
| Alcohol | Fórmula | p. f. | p. e. | Densidad |
| metílico etílico n-propílico iso-propílico n-butílico sec-butílico |
CH3OH C2H5OH CH3-CH2-CH2OH (CH3)2CHOH CH3(CH2)2CH2OH CH3CH2-CHOH-CH3 |
- 97,8 -117,3 -127,0 - 85,8 - 89,8 |
64,5 78,5 97,8 82,3 117,7 99,5 |
0,792 0,789 0,804 0,786 0,810 0,808 |
Como se puede observar en la tabla, el punto de ebullición de los alcoholes secundarios es menor que el de los primarios correspondientes; el punto de fusión resulta mayor, y la densidad, semejante.
Los alcoholes terciarios son todos sólidos.
Ejercicios de repaso:
Esquematizar las fórmulas de los alcoholes del cuadro precedente.
Escribir las estructuras de los ocho alcoholes de fórmula molecular C5H12O. Nombrarlos según la nomenclatura IUPAC y clasificarlos como primarios, secundarios o terciarios.
lunes, 1 de julio de 2013
Funciones orgánicas oxigenadas
Ya hemos hablado de la halogenación de los hidrocarburos en otra publicación, ahora nos referimos a las que en su función incluyen al elemento oxígeno.
Función alcohol
Los alcoholes son sustancias que tienen un grupo oxhidrilo (OH) unido a un carbono en una cadena hidrocarbonada. Se pueden considerar pues, como derivados de la sustitución, en un hidrocarburo, de un átomo de hidrógeno por un oxhidrilo.
Ejemplos:
Los alcoholes se clasifican en primarios, secundarios y terciarios, si se tiene en cuenta la posición del grupo OH.
Cuando este grupo está ubicado en un carbono primario, el alcohol será primario. Ejemplos [1], [2] y [4].
Si reemplazamos por R todo el radical unido al carbono que lleva el oxhidrilo, podemos representar un alcohol primario por R - CH2OH.
En el alcohol secundario, el oxhidrilo está ubicado en un carbono secundario (unido a dos carbonos). Así ocurre en la fórmula [5], que se puede esquematizar de este modo:
Función alcohol
Los alcoholes son sustancias que tienen un grupo oxhidrilo (OH) unido a un carbono en una cadena hidrocarbonada. Se pueden considerar pues, como derivados de la sustitución, en un hidrocarburo, de un átomo de hidrógeno por un oxhidrilo.
Ejemplos:
Cuando este grupo está ubicado en un carbono primario, el alcohol será primario. Ejemplos [1], [2] y [4].
Si reemplazamos por R todo el radical unido al carbono que lleva el oxhidrilo, podemos representar un alcohol primario por R - CH2OH.
En el alcohol secundario, el oxhidrilo está ubicado en un carbono secundario (unido a dos carbonos). Así ocurre en la fórmula [5], que se puede esquematizar de este modo:
H
|
R - C - R
|
OH
Los alcoholes terciarios contienen el oxhidrilo en un carbono terciario, es decir unido a otros tres carbonos. Esta situación se presenta únicamente en un carbono ramificado, como sucede en la fórmula [3]. Si representamos por R a los grupos unidos a ese carbono, queda como expresión general de un alcohol terciario:
R
|
R - C-OH
|
R
Los grupos en color rojo, en cada fórmula, característicos de cada uno de los tres tipos de alcoholes, son sus grupos funcionales.
Ejercicios:
Teniendo en cuenta la nomenclatura (ya conocida) de la IUPAC en los hidrocarburos y agregando una "ele" en la terminación, nombrar las moléculas que faltan:
- CH3OH (ver [1]): metanol ó alcohol metílico (primario)
- CH3 - CH2OH (ver [2]): ______________________ (primario)
- CH3 - CHOH - CH3 (ver [5]): 2 propanol (secundario)
- (ver [3]): ________________________ (terciario)
Saludos.
miércoles, 19 de junio de 2013
Hidrocarburos de cadena cerrada
Comprenden dos subgrupos:
1) alicíclicos; 2) aromáticos o bencénicos
Hidrocarburos alicíclicos
Tienen la cadena de carbonos en forma de anillo y las uniones entre ellos son generalmente simples. Por parecerse sus uniones a las de los alcanos, también se los llama cicloalcanos.
La serie comienza con el hidrocarburo de 3 carbonos denominado ciclopropano (C3H6).
Se conocen ciclos de 4, 5, 6, 7, 8 y más átomos de carbono, pero los más frecuentes e importantes son los de 5 y 6 carbonos. Sus fórmulas son: C4H8, C5H10, C6H12 y sus estructuras las siguientes:
Forman un grupo de sustancias que tienen como característica estructural la presencia de uno o más anillos de seis átomos de carbono con tres enlaces dobles y otros tres simples en forma alternadas, distribución que se llama sistema de dobles enlaces conjugados.
El hidrocarburo más importante de esta familia es el benceno (ciclohexatrieno):
y por esta razón todos los representantes de esta serie se llaman también hidrocarburos bencénicos.
1) alicíclicos; 2) aromáticos o bencénicos
Hidrocarburos alicíclicos
Tienen la cadena de carbonos en forma de anillo y las uniones entre ellos son generalmente simples. Por parecerse sus uniones a las de los alcanos, también se los llama cicloalcanos.
La serie comienza con el hidrocarburo de 3 carbonos denominado ciclopropano (C3H6).
Se conocen ciclos de 4, 5, 6, 7, 8 y más átomos de carbono, pero los más frecuentes e importantes son los de 5 y 6 carbonos. Sus fórmulas son: C4H8, C5H10, C6H12 y sus estructuras las siguientes:
cilopropano ciclohexano
Muchas veces se esquematizan representando solamente el anillo (arriba) sobreentendiendose que los lados de la figura son las valencias de unión, y que en la interesección de dos valencias está el carbono con el número de hidrógenos que le conrresponda.
A veces estos hidrocarburos presentan algún enlace doble; entonces cambian la terminación de su nombre por eno:
cilopenteno 1,3 ciclohexadieno
Hidrocarburos aromáticosForman un grupo de sustancias que tienen como característica estructural la presencia de uno o más anillos de seis átomos de carbono con tres enlaces dobles y otros tres simples en forma alternadas, distribución que se llama sistema de dobles enlaces conjugados.
El hidrocarburo más importante de esta familia es el benceno (ciclohexatrieno):
y por esta razón todos los representantes de esta serie se llaman también hidrocarburos bencénicos.
Isomería de alquenos
Presentan, al igual que los alcanos, isomería de cadena o ramificación:
2 penteno 3 metil 1 buteno
Además, presentan otro tipo de isómeros, caracterizados por tener la misma fórmula molecular e idéntica cadena hidrocarbonatada pero distinta ubicación del doble enlace. Se llaman isómeros de posición:
Ejercicio:
Escribir todas las estructuras posibles de un alqueno de fórmula C5H10. Nombrarlos según las reglas de la IUPAC.
Reacciones de sustitución - Halogenación
Las uniones C-C y C-H son estructuras muy estables, pero en condiciones apropiadas, con reactivos enérgicos y a temperaturas y presiones elevadas y la presencia de catalizadores, originan reacciones en las que los hidrógenos del alcano se sustituyen por algún otro átomo o grupo atómico.
Halogenación
Los alcanos reaccionan con los halógenos, formando compuestos de sustitución. La sustitución de uno o más átomos de hidrógeno por un halógeno ocurre lentamente en la oscuridad, pero más rápidamente en presencia de luz solar (reacción fotoquímica).
La cloración del metano da lugar a la formación de los siguientes compuestos:
H Cl
| |
H - C - H + Cl2 ---> HCl + H - C - H
| |
H H
| |
H - C - H + Cl2 ---> HCl + H - C - Cl
| |
H H
Cl Cl
| |
H - C - Cl + Cl2 ---> HCl + H - C - Cl
| |
H Cl
Halogenación
Los alcanos reaccionan con los halógenos, formando compuestos de sustitución. La sustitución de uno o más átomos de hidrógeno por un halógeno ocurre lentamente en la oscuridad, pero más rápidamente en presencia de luz solar (reacción fotoquímica).
La cloración del metano da lugar a la formación de los siguientes compuestos:
H Cl
| |
H - C - H + Cl2 ---> HCl + H - C - H
| |
H H
clorometano o cloruro de metilo
Cl Cl| |
H - C - H + Cl2 ---> HCl + H - C - Cl
| |
H H
diclorometano o cloruro de metileno
| |
H - C - Cl + Cl2 ---> HCl + H - C - Cl
| |
H Cl
triclorometano o cloroformo
Cl Cl
| |
H - C - Cl + Cl2 ---> HCl + Cl - C - Cl
| |
Cl Cl
tetraclorometano o tetracloruro de carbono
La reactividad de los alcanos con los halógenos decrece del flúor al yodo.
viernes, 14 de junio de 2013
Masa atómica relativa
¿Es lo mismo que masa atómica o simplemente masa? no.
¿Cuál es la diferencia? veamos:
Al hablar de masa de un átomo, debemos saber que la denominamos en UMAs (unidades de masa atómica).
Pensemos en la masa de un átomo en particular, por ejemplo el C (carbono). En la tabla periódica dice que tiene 6 protones y asumimos, en principio, 6 neutrones, lo cual nos dice que el átomo de C debería pesar 12 UMAs. (Esa es la masa del isótopo 12C)
Pero al mirar en la tabla periódica, dice 12,011 UMAs. Sucede que la tabla periódica informa la masa atómica relativa y ésta surge teniendo en cuenta los isótopos del elemento.
En general, los isótopos más estables existen comúnmente en la naturaleza y se les denomina isótopos naturales. Otros isótopos, tienen una vida media muy pequeña, en el orden de los segundos, horas o días, estos isótopos son generalmente obtenidos de forma artificial. Finalmente, existen isótopos cuyas vidas medias están en el orden de los años; por ejemplo el 14C, que tiene una vida media de 5,730 años, estos isótopos (particularmente el 14C), se emplean para determinar la edad de algunos restos fósiles u objetos arqueológicos. La vida media de un isótopo es el tiempo en el cual la mitad de la muestra de un isótopo inestable, se convierte en un isótopo más estable. Por ejemplo, si se tienen 100 [g] de 14C, deberán de transcurrir 5,730 años para que 50 [g] de la muestra se conviertan en 12C.
Con base en lo anterior, se puede afirmar que la muestra de un elemento cualquiera, estará constituida por varios isótopos del elemento, en diferentes porcentajes, los cuales se conocen como porcentajes de abundancia natural; sin embargo, para fines prácticos, solo se consideran los porcentajes de los isótopos más estables; así por ejemplo, para una muestra de carbono solo se considera el 12C, en un 98.892 [%] y el 13C en un 1.108 [%]; esto claro, no significa que no existan en la muestra otros isótopos del carbono, sino que simplemente, la cantidad de estos es tan pequeña que puede despreciarse.
Luego para que la masa promedio de 12.011 se calcula así:
¿Cuál es la diferencia? veamos:
Al hablar de masa de un átomo, debemos saber que la denominamos en UMAs (unidades de masa atómica).
Pensemos en la masa de un átomo en particular, por ejemplo el C (carbono). En la tabla periódica dice que tiene 6 protones y asumimos, en principio, 6 neutrones, lo cual nos dice que el átomo de C debería pesar 12 UMAs. (Esa es la masa del isótopo 12C)
Pero al mirar en la tabla periódica, dice 12,011 UMAs. Sucede que la tabla periódica informa la masa atómica relativa y ésta surge teniendo en cuenta los isótopos del elemento.
En general, los isótopos más estables existen comúnmente en la naturaleza y se les denomina isótopos naturales. Otros isótopos, tienen una vida media muy pequeña, en el orden de los segundos, horas o días, estos isótopos son generalmente obtenidos de forma artificial. Finalmente, existen isótopos cuyas vidas medias están en el orden de los años; por ejemplo el 14C, que tiene una vida media de 5,730 años, estos isótopos (particularmente el 14C), se emplean para determinar la edad de algunos restos fósiles u objetos arqueológicos. La vida media de un isótopo es el tiempo en el cual la mitad de la muestra de un isótopo inestable, se convierte en un isótopo más estable. Por ejemplo, si se tienen 100 [g] de 14C, deberán de transcurrir 5,730 años para que 50 [g] de la muestra se conviertan en 12C.
Con base en lo anterior, se puede afirmar que la muestra de un elemento cualquiera, estará constituida por varios isótopos del elemento, en diferentes porcentajes, los cuales se conocen como porcentajes de abundancia natural; sin embargo, para fines prácticos, solo se consideran los porcentajes de los isótopos más estables; así por ejemplo, para una muestra de carbono solo se considera el 12C, en un 98.892 [%] y el 13C en un 1.108 [%]; esto claro, no significa que no existan en la muestra otros isótopos del carbono, sino que simplemente, la cantidad de estos es tan pequeña que puede despreciarse.
Luego para que la masa promedio de 12.011 se calcula así:
12*98.892 + 13*1.108 = 12.011
100
Isótopos del hidrógeno, del boro, del carbono, del nitrógeno, del oxígeno, del neón, del cloro y del estaño. | Elemento | Isótopo | Masa (u) | Abundancia (%) | Masa atómica (u) |
|---|---|---|---|---|
Hidrógeno
|
1H
|
1,007825
|
99,985
|
1,00798
|
2H
|
2,0140
|
0,015
| ||
| Boro |
10B
|
10,0129
|
19,78
|
10,812
|
11B
|
11,00931
|
80,22
| ||
| Carbono |
12C
|
12,0000
|
98,89
|
12,01114
|
13C
|
13,00335
|
1,11
| ||
| Nitrógeno |
14N
|
14,00307
|
99,63
|
14,0067
|
| Oxígeno |
16O
|
15,99491
|
99,759
|
15,9994
|
17O
|
16,99884
|
0,037
| ||
18O
|
17,9972
|
0,204
| ||
| Neón |
20Ne
|
19,99244
|
89,97
|
20,190
|
21Ne
|
20,99385
|
0,30
| ||
22Ne
|
21,99138
|
9,73
| ||
| Cloro |
35Cl
|
34,96885
|
75,53
|
35,457
|
37Cl
|
36,96600
|
24,47
| ||
| Estaño |
112Sn
|
111,904826
|
0,97
|
118,710
|
114Sn
|
113,902784
|
0,66
| ||
115Sn
|
114,903348
|
0,34
| ||
116Sn
|
115,901747
|
14,54
| ||
117Sn
|
116,902956
|
7,68
| ||
118Sn
|
117,901609
|
24,22
| ||
119Sn
|
118,903311
|
8,59
| ||
120Sn
|
119,902199
|
32,58
| ||
122Sn
|
121,903440
|
4,63
| ||
124Sn
|
123,905274
|
5,79
|
Isótopos
Un mismo elemento químico puede estar constituído por átomos diferentes, es decir, sus números atómicos son iguales, pero el número de neutrones es distinto. Estos átomos se denominan isótopos del elemento en cuestión. Isótopos significa "mismo lugar", es decir, que como todos los isótopos de un elemento tienen el mismo número atómico, ocupan el mismo lugar en la Tabla Periódica.
Por tanto:
Los isótopos del carbono son 116C (6 protones y cinco neutrones), 126C (6 protones y seis neutrones), 136C (6 protones y siete neutrones) y 146C (6 protones y ocho neutrones).
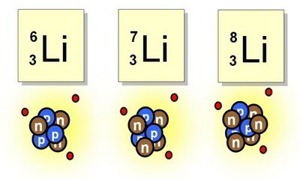
En el elemento Litio encontramos tres isótopos:
Por tanto:
- Si a un átomo se le añade un protón, se convierte en un nuevo elemento químico
- Si a un átomo se le añade un neutrón, se convierte en un isótopo de ese elemento químico
Se conocen 3 isótopos del elemento hidrógeno: 11H es el hidrógeno ligero, el más abundante, con un protón y cero neutrones. El 21H es el deuterio (D), cuyo núcleo alberga un protón y un neutrón y el 31H es el tritio (T), cuyo núcleo contiene un protón y dos neutrones.
Isótopos del hidrógeno
|
 |
Los isótopos del carbono son 116C (6 protones y cinco neutrones), 126C (6 protones y seis neutrones), 136C (6 protones y siete neutrones) y 146C (6 protones y ocho neutrones).
Isótopos del carbono
|
 |
En el elemento Litio encontramos tres isótopos:
Isótopos del litio
|
|
|
martes, 11 de junio de 2013
Propiedades físicas de los alcanos
El metano, el etano, el propano y los butanos son gaseosos; a partir del pentano y hasta el de 16 átomos de carbono son líquidos; los restantes, sólidos. En los alcanos de cadena normal, los puntos de ebullición aumentan regularmente de un término a otro, entre 25 y 30 °C.
Nombre
|
P de fusión
|
P de ebullic
|
Densidad
|
Calor de combustión
(kcal/mol)
|
| Metano |
-183
|
-162
|
0,42
|
211
|
| Etano |
-172
|
- 89
|
0,55
|
368
|
| Propano |
-187
|
- 42
|
0,58
|
526
|
| n-butano |
-135
|
- 0,5
|
0,58
|
683
|
| n-pentano |
-130
|
36,2
|
0,63
|
838
|
| n-hexano |
- 94
|
69
|
0,66
|
991
|
| n-heptano |
- 90
|
98
|
0,68
|
1150
|
| n-octano |
- 57
|
126
|
0,70
|
1305
|
| n-nonano |
- 54
|
151
|
0,72
|
1462
|
| n-decano |
- 30
|
174
|
0,73
|
1610
|
Estado natural de los alcanos
Se encuentran en la naturaleza, constituyendo principalmente los petróleos, los gases naturales que surgen de estos yacimientos y los gases de los yacimientos de carbón.
El gas natural es la fuente principal para la obtensión de los primeros alcanos. Tiene la siguiente composición:
El gas natural es la fuente principal para la obtensión de los primeros alcanos. Tiene la siguiente composición:
- metano: 80%
- etano: 13%
- propano: 3%
- butano: 1%
- nitrógeno: 3%
Fuente: DE BIASIOLI y otros: Química orgánica (1990), KAPELUZ, Bs. As.
viernes, 7 de junio de 2013
Trabajo de los alumnos de 5° 1a
Muestro algunos trabajos realizados por los alumnos. El tema era Hidrocarburos.
Póximamente publicaré más producciones.
Mis felicitaciones a ellos.
Saludos.
Póximamente publicaré más producciones.
Mis felicitaciones a ellos.
Saludos.
Isomería de los alcanos
Recordemos que:
La fórmula molecular proporciona el número de cada clase de átomo en un compuesto.
La fórmula estructural de un compuesto proporciona la disposición de los enlaces de los átomos de una molécula.
Por ejemplo el butano tiene las siguientes fórmulas:
Fórmula molecular fórmula estructural
C4H10 CH3-CH2-CH2-CH3
La isomería es la parte de la Química que estudia los isómeros.
Los isómeros son compuestos con la misma fórmula molecular pero diferentes fórmulas estructurales. Por tener igual fórmula molecular poseen igual número y clase de átomos, poseen igual masa molecular. Para poder afirmar que dos compuestos son isómeros deben diferir en por lo menos en una propiedad física o química y en su disposicion espacial.
Ejemplo:
n-butano isobutano (metil propano)
CH3-CH2-CH2-CH3 CH3-CH1-CH3
|
CH3
Con el prefijo iso, debe entenderse que se trata de un isómero del butano. Entre paréntesis se escribió la nomenclatura de la IUPAC (Unión Internacional de Química Pura y Aplicada), que es la que estuvimos estudiando en las últimas clases. Ahora contamos con dos formas de llamar a las moléculas ramificadas de hidrocarburos.
La palabara isómero proviene del griego: isos (igual), meros (partes).
Ejercicios (deben estar en la carpeta junto a la teoría):
1) Escribir todos los isómeros posibles que responden a la fórmula C6H14. Nombrarlos según las reglas de la IUPAC.
2) Ídem anterior con la fórmula C7H16.
Saludos.
La fórmula molecular proporciona el número de cada clase de átomo en un compuesto.
La fórmula estructural de un compuesto proporciona la disposición de los enlaces de los átomos de una molécula.
Por ejemplo el butano tiene las siguientes fórmulas:
Fórmula molecular fórmula estructural
C4H10 CH3-CH2-CH2-CH3
La isomería es la parte de la Química que estudia los isómeros.
Los isómeros son compuestos con la misma fórmula molecular pero diferentes fórmulas estructurales. Por tener igual fórmula molecular poseen igual número y clase de átomos, poseen igual masa molecular. Para poder afirmar que dos compuestos son isómeros deben diferir en por lo menos en una propiedad física o química y en su disposicion espacial.
Ejemplo:
n-butano isobutano (metil propano)
CH3-CH2-CH2-CH3 CH3-CH1-CH3
|
CH3
Con el prefijo iso, debe entenderse que se trata de un isómero del butano. Entre paréntesis se escribió la nomenclatura de la IUPAC (Unión Internacional de Química Pura y Aplicada), que es la que estuvimos estudiando en las últimas clases. Ahora contamos con dos formas de llamar a las moléculas ramificadas de hidrocarburos.
La palabara isómero proviene del griego: isos (igual), meros (partes).
Ejercicios (deben estar en la carpeta junto a la teoría):
1) Escribir todos los isómeros posibles que responden a la fórmula C6H14. Nombrarlos según las reglas de la IUPAC.
2) Ídem anterior con la fórmula C7H16.
Saludos.
Tabla periódica interactiva
Para obtener información completa de cada elemento con facilidad y agilidad, les dejo el siguiente enlace:
Tabla periódica interactiva
Saludos, profe RJC.
Tabla periódica interactiva
Saludos, profe RJC.
Mapa curricular de Introducción a la Química Orgánica
Para saber lo que se espera dar en el año:
Extracto de: Diseño Curricular para la Educación Secundaria Ciclo Superior 5to año Introducción a la Química.
| CONCEPTOS ORGANIZADORES | Proceso, cambio, conservación |
| Eje Temático 1: Química y combustibles | El petróleo como recurso. Relación estructura-propiedades. Relaciones estequiométricas. |
| Eje Temático 2: Química y alimentación | Núcleo 1: Principales grupos de biomoléculas Núcleo 2: Alimentos, actividad y energía. Dietas y energía necesaria para los procesos vitales de acuerdo a la actividad |
| Eje temático 3: Química en procesos industriales | Núcleo 1: Procesos de equilibrio. Principio de Le Chatelier. Producción de Amoníaco. Núcleo 2: Metales y Metalurgia. Estequiometría. Pureza de los reactivos y cálculo de pureza. Rendimiento de las reacciones químicas. |
¡Bienvenidos!
Estimados alumnos, comenzamos un recorrido diferente. Desde este sitio estaremos compartiendo un espacio virtual al que asistiremos en el momento que cada uno pueda, y encontrarán artículos, imágenes e información, todos ellos útiles para la cursada de la materia.
Saludos, profe RJC.
Saludos, profe RJC.
Suscribirse a:
Entradas (Atom)